同素体と同位体 あなたはこの名前が似てる2つの違いを説明できますか?
今回はこの2つの違いと覚え方を図を
使って分かりやすく解説します。
同素体と同位体の定義
まず同素体と同位体の違いを検索すると次のように出てきます。
【同素体】
同じ元素からなるが構造や性質が異なる物質
【同位体】
原子番号は同じで中性子の数が異なる原子同士
これだけで分かった人はそっとブラウザ閉じてOKです笑
でもこれだけだと「難しい…」と思う人も多いと思うので分かりやすい図や例を紹介します。
同素体とは (同素体の例)
同素体の定義は
同じ元素からなるが構造や性質が異なる物質
ですが
これだけじゃ分かりにくいので
ダイヤモンドとグラファイト(鉛筆の芯などの材料)を例にします。
みなさんご存知の通り
ダイヤモンドと鉛筆の芯はどう見ても別物に
見えますよね。

でも実はこの2つは両方とも炭素(C)という元素でできてるんです。
このように同じ元素でできているのに構造や性質が違う物質を同素体と言います。
同素体は他にも
S(硫黄)...斜方硫黄, 単射硫黄, ゴム状硫黄
C(炭素)...ダイヤモンド,グラファイト,フラーレン
O(酸素)...酸素(O2), オゾン(O3)
P(リン)...黄リン, 赤リン
などがあります。
またこの4つの元素を縦読みして
SCOP(スコップ)と読めるので
同素体といえばSCOP(スコップ)
と覚えましょう!
ちなみに同じ元素なのに見た目が変わる理由については
簡単に言うと元素のくっつき方(平面とか立体とか)の違い
などで性質の違いが生まれる為です。
続いて同位体について解説していきます。
中性子と同位体
まず同位体は中性子の数の違いがポイントとなるので理解するには中性子が何か知っとく必要があります。
正直この中性子が何か知らないと同位体を理解するのはかなり厳しいです。
中性子とは簡単に言えば
原子核を構成する小さな粒ですが
「中性子ってなんだ?分からん!」って方は
こちらを見てください。
次にリチウムを例に同位体を紹介します。
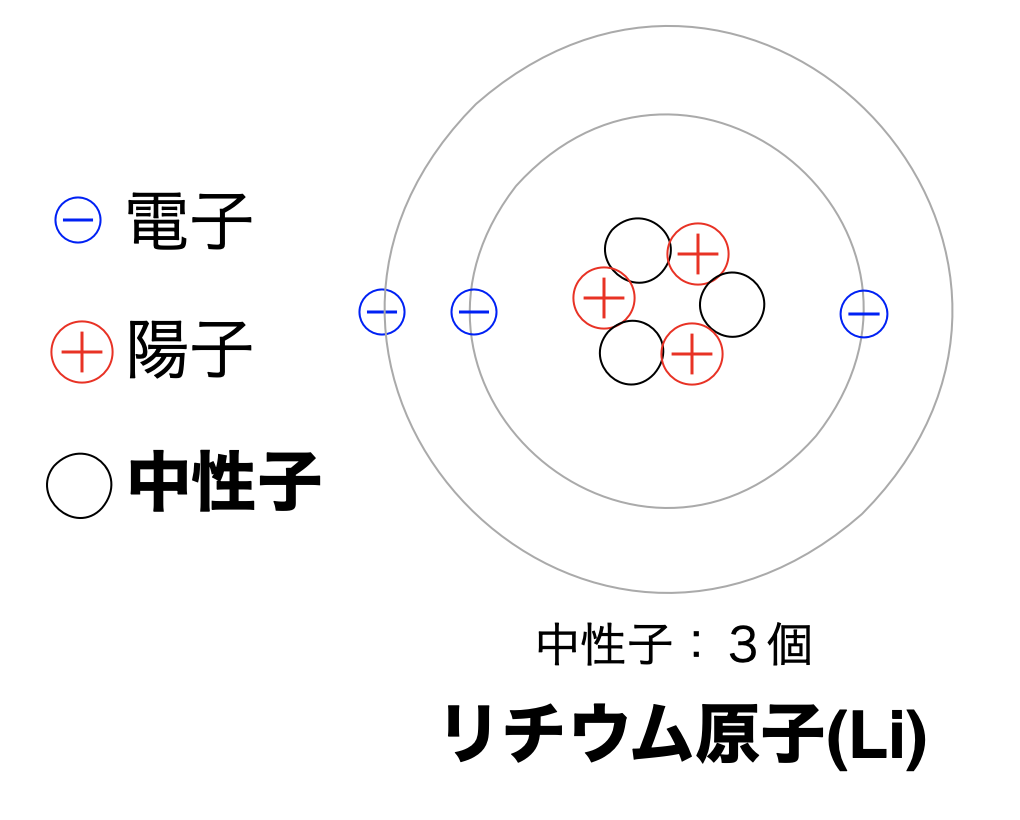
上の図の原子番号3(Li)のように中性子は原子に
含まれていて基本的には原子番号とだいたい同じ数存在していますが、、
中性子の数は厳密には決まっていなくて違う数の中性子を持つ原子があります。(下図)
このように違う数を持つ中性子を持つ原子同士のことを同位体と言います。
また先ほどの図のような電子配置の
他に次の表記で同位体を表すこともできます。
図の数字は左上は質量数(陽子数+中性子数)、
左下は原子番号(陽子数)を表しているので
中性子数=(質量数ー陽子の数)
=(左上の数字ー左下の数字)
なので左側の2つの数字を見るだけで
中性子の数が分かります。(詳しくはこちら)

例えば図の左のLiは質量数6,陽子の数3なので
6−3=3 で中性子数は3だと分かります。
同様に図の右のLiは7-3=4
なので中性子数は4だと分かります。
このように「同じ元素なのに中性子の数違うじゃん」ってなったら
それは同位体であると言えます。
また
中性子が多すぎるとその原子は放射能を持ち
放射性同位体(ラジオアイソトープ)
と呼ばれます。
*放射能:放射線を発する能力
まとめ
・同素体と同位体の違い
【同素体】
同じ元素からなるが構造や性質が異なる物質
【同位体】
原子番号は同じで中性子の数が異なる原子同士
・同素体の例
S(硫黄)...斜方硫黄, 単射硫黄, ゴム状硫黄
C(炭素)...ダイヤモンド,グラファイト,フラーレン
O(酸素)...酸素(O2), オゾン(O3)
P(リン)...黄リン, 赤リン
同素体の覚え方はSCOP(スコップ)
・同位体の例
次のような
同じ元素だけど中性子の数が異なる原子同士
例:原子番号3 リチウム(Li)

「同じ元素なのに中性子の数違うじゃん」
ってなったら同位体
・放射性同位体
中性子が多すぎると原子は放射能を持ち
放射性同位体(ラジオアイソトープ)
と呼ばれる
今回は以上になります。
他にも
[説明できる?]元素 原子 分子の違い - ゼロからの化学基礎
という記事もあるので良かったら見てみてください。
読者登録やいつもスター押してくれてる方
本当にありがとうございます。
スターや読者登録していただけると励みになります