誰もがマイナスイオンなど「イオン」って言葉を一度は耳にしたことがあるのではないでしょうか。
でも この「イオン」ってなんなのか説明できますか?
今回はそんなイオンについて解説していきたいと思います。
今回、解説するイオンは化学結合とか水溶液の話の時に役立ちます。
また、イオンを理解するには価電子や電子配置の知識があった方が楽なので、「電子配置とか価電子とかわかんない」って方は良かったら先に電子配置の書き方と価電子と周期表の関係をご覧ください。
前置き
今回は周期表の1~20番の元素についての話なので21番以降の元素には当てはまらない場合があります。
・単原子イオンと多原子イオン
→イオンには
原子を1つしか含まない単原子イオン(H+, Na+, S2-, Cl- など)と
原子を複数含む多原子イオン(SO42-, NH4+ など)がありますが、今回は単原子イオンについて解説していきます。
イオンってなに?
・ イオンとは
電子の増減によりプラス(正)の電荷またはマイナス(負)の電荷を帯びた原子のことですが、これだけ言われても「よくわかんない」っていう人の方が多いかもしれません。
なので
イオンは希ガス(18族)と同じ電子配置になって
+やーに偏った原子が多いってことをとりあえず覚えといてください。(原子番号21番のスカンジウム以降は必ずしも当てはまるわけではない)
イオンの種類と表記の仕方
イオンは次の陽イオンと陰イオンの2種類に分けられます。
・陽イオン:正電荷を帯びたイオン
(例:Na+,Mg2+など)
表記は元素記号の右上に+(プラス)をつける。
1+の場合は1をつけないで+だけ書く。
(数学の1x=x みたいな感じ)
○○イオンと呼ぶ(例:ナトリウムイオン,マグネシウムイオンなど)
・陰イオン:負電荷を帯びたイオン
(例:F-,S2-など)
表記は元素記号の右上に-(マイナス)をつける。
1-の場合は1をつけないで-だけ書く。
(数学の1x=x みたいな感じ)
○○化物イオンと呼ぶことが多い
(例:フッ化物イオン,硫化物イオンなど)
*陽イオンと違ってイオンの前に化物を入れるのを忘れないように!
これらのように元素記号の右上に+やーをつけてイオンを表したもの(Na+,Mg2+,F-,S2- など)を
イオン式という。
陽イオンの詳細
まずは原子について思い出してもらいたいのですが、原子には正電荷をもつ陽子と負電荷をもつ電子が同じ個数存在しています。(何言ってるか分からんって人は「原子とは」を見てね)

(プラスの陽子11個の周りにマイナスの電子が11個でちょうどプラマイゼロ)
このように原子はプラス(正)とマイナス(負)が
同じ数でちょうど打ち消しあっているので、原子全体で見るとプラス(正)にもマイナス(負)にも偏ってないのです。
したがって、原子はマイナスである電子を失うとプラス(正)に偏って陽イオンになります。
例:元素番号11のナトリウム(Na)の場合
Naは正電荷(プラス)を持つ陽子11個と負電荷(マイナス)を持つ電子11個で打ち消しあっています。
つまり次の図のように負電荷の電子を1つ失うことで陽子11個、電子10個になり、プラスに1つ偏って陽イオンのナトリウムイオン(Na+)になります。
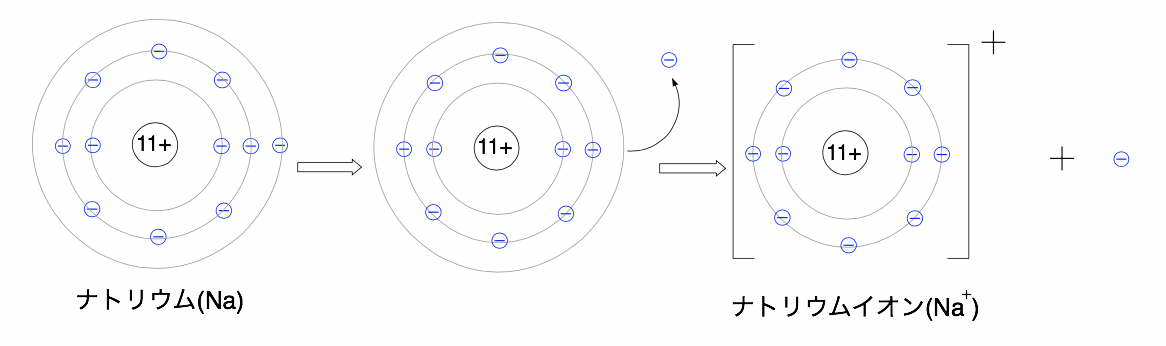
上の図を反応式で表すと次のようになります。
Na →Na++e-
* eはelectron(電子)の頭文字
陰イオンの詳細
次は陰イオンについてです。
原子は電子が増えることでマイナス(負)に偏って陰イオンになります。
例:元素番号9のフッ素(F)の場合
Fは正電荷を持つ陽子9個と負電荷を持つ電子9個で打ち消しあっているということになります。
つまり負電荷の電子を1つ受け取ることで陽子9個、電子10個になり、マイナスに1つ偏って
陰イオンのフッ化物イオン(F-)になります。
 上の図を反応式で表すと次のようになります。
上の図を反応式で表すと次のようになります。
F +e-→ F-
これらの話をまとめると
原子は電子を失うと陽イオン、電子を受け取ると陰イオンになります。
←これめちゃくちゃ大事なのでよく分からんって人もこれだけは覚えといてください🙏
価数について
原子がイオンになるときに先ほどの例で電子が
出入りしてましたが、この出入りする電子の数を価数と呼び、この価数に応じて○価のイオンという言い方をします。
例えば先ほどのNa+とF-は電子の出入りが1つだったので両方とも価数は1
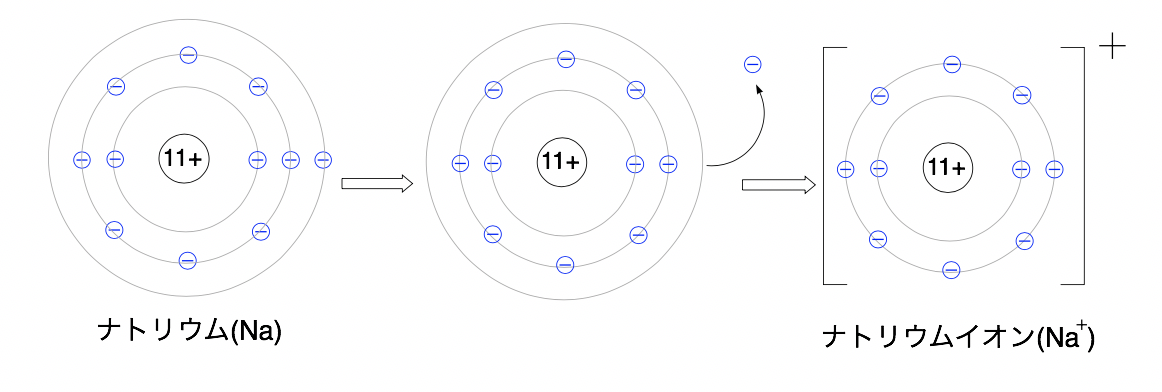

なので、Na+は1価の陽イオン, F-は1価の陰イオンと呼ばれます。
また、2つ以上の電子が出入りしてプラスまたはマイナスに2つ以上偏ったイオン、すなわち価数が2以上のイオンも存在します。
(例:Mg2+, S2-, Al3+など)
例えばこんなやつ↓

ここまで読んでて
「マグネシウムは2価の陽イオンでフッ素は1価の陰イオンとか全部覚えなきゃいけないの?」
「なんか法則みたいなやつないの?」
って思って方もいるかもしれません。
安心してください。ちゃんと価数を見分ける方法があります。
「何価の陽イオンか陰イオンか見分ける方法と周期表(電子配置)との関係」
結論から言うと
何価の陽イオンか陰イオンか見分けるには
その元素が周期表の何族か分かれば見分けることができます。
といきなり言われてもよくわからないので
まずはイオンの電子配置について
理解しましょう。
イオンの電子配置は
希ガス(18族)と同じ電子配置
になることが多いです。
また、高校化学でよく出てくる元素番号1〜20の中では1, 2, 16, 17族の元素がイオンになりやすいです。

先ほど紹介したナトリウムイオンとフッ化物イオンの電子配置を見ると...
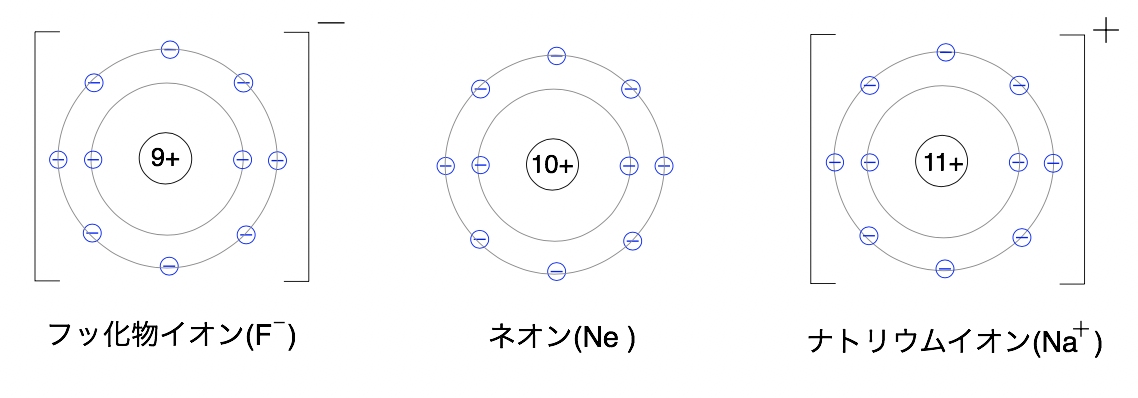
図のように
両方のイオンの電子配置は希ガス(18族)のネオン(Ne)と同じになります。
では、なぜ同じ電子配置になるのか?
一言でいうとフッ素(F)もナトリウム(Na)も安定化したいからです。
原子は多少プラスやマイナスに偏ってでも、希ガスと同じ電子配置になって安定化したいんです。(電子配置の安定の話はこちら)
そして原子は、イオンになるときに
周期表で自分と一番近い希ガスと同じ電子配置になろうとします。
←これめっちゃ重要
これについては価電子のことを思い出してあげると簡単です。(価電子ってなんだっけ?ってなったらこちらを見てね)
この価電子の数によって陽イオンになるか陰イオンになるか決まります。
例えば下の図のように
1族の原子(価電子1)であるナトリウムは電子を7個もらって陰イオンになるより
電子を1個失って陽イオンになる方が出入りする電子数が少ないので
楽にイオン化できるので陽イオンになります。
同様に2族の原子(価電子2)も同様に電子を6個もらうより電子を2個失う方が楽なので陽イオンになります。


よって
ナトリウム(電子11個)が希ガスと同じ電子配置になってイオン化しようとすると電子18個のアルゴン(Ar)と同じ電子配置になるより
電子10個のネオン(Ne)と同じ電子配置になる方が出入りする電子の数が少なく、圧倒的に楽なのでナトリウムはNa-7ではなくNa+になる。
同様の理由で16族,17族の場合は電子を手放すより、電子をもらう方が出入りする電子数が少ないので陰イオンになりやすいです。
色々難しい言い方をしましたが
要は価電子の数を0に合わせる方が近いか8に合わせるほうが近いかって言う話です。
価電子数が0に近い1族と2族は陽イオンになりやすく、価電子数が8に近い16族と17族は陰イオンになりやすいということです。 (価電子数は下の表をみてね)


(赤で囲った元素が陽イオンになるやつ、青で囲った元素が陰イオンになるやつ)
ちなみに高校化学でよく出てくる元素番号1〜20の中ではこの赤と青で囲った1, 2, 16, 17族の元素に加えて、13族のアルミニウム(Al)もイオンになりやすいです。
このアルミニウムは価電子が3つで、0と8なら0の方が近いので下のように3つの電子を失って3価の陽イオンになります。
Al →Al+3+3e-

とにかく1~20番のイオンは、1族,2族 16族,17族,アルミニウムを覚えとけばOKです。
まとめ
1.イオンとは
電子の増減によりプラス(正)の電荷またはマイナス(負)の電荷を帯びた原子
2.陽イオンと陰イオン
電子を失うと陽イオン、電子を受け取ると陰イオンになる。
陽イオンは○○イオン、陰イオンは○○化物イオンと呼ぶ。
3.価数
原子がイオンになるときに出入りする電子の数
基本的に価電子の数によって決まる。
よって、周期表の族で価数がわかる。
4.覚えとくべきイオン
1~20番のイオンは、1族,2族 16族,17族,アルミニウムを覚えましょう。
今回は以上になります。
最後まで読んでいただきありがとうございました。