今回は共有結合について例を使って分かりやすく特徴など詳しく解説します。
また、簡単にできるイオン結合との見分け方なども紹介します。
共有結合とは
原子同士が価電子を共有することによって
できる結合が共有結合です。
そして下図が
塩素の共有結合を電子式で表したものです。
「価電子を共有?」
「電子式?」
電子式とか価電子を共有といきなり
言われてもピンと来にくいですよね
そこでまず価電子と電子式について説明するので
「それは知ってるから
早く共有結合を教えてくれよ」
って方は下の目次から
「原子が安定化する方法」まで
飛ばしてみるのをオススメします。
価電子と電子式について
価電子とは
簡単にいうと中途半端に余った電子です。
もう少し詳しくいうと
閉殻してない原子の最外殻電子のことです。www.kemisupea.com
そしてその価電子を数を分かりやすくしたのが
下のような電子式です。(例:塩素Cl)
図の黒丸が価電子(最外殻電子)を
表していて塩素原子は
価電子が7個なので黒丸は7個描きます。
※価電子の数が分かる方法はこの記事をご覧ください。www.kemisupea.com
また下図から分かるように電子式は
電子2つを1つのペアとして描きます。
図の赤線で囲ったペアの事を
電子対(でんしつい)と言い、ペアになってない
電子を不対電子(ふついでんし)と言います。
したがって
塩素原子は3つの電子対と1つの不対電子が
あると分かります。
つまり
塩素原子はあと1つ電子をゲットすれば電子対を
作って4つの電子対を持つことができます。
塩素原子は上図のように
不対電子がなくなって全てが電子対になると
安定化します。
これは他の原子にも言えて安定化する為に
電子8個(電子対4つ)を目指します。
(ただし水素は例外)
これは閉殻をイメージすると分かりやすいです。
(閉殻について詳しくはこちら)www.kemisupea.com
もし閉殻とかよく分かんないって方は
これだけは覚えといてください。
「電子式は基本的に
電子(黒丸)が8個なら安定で
水素の場合は2個なら安定」
そしてもちろん原子は不安定な状態より
安定な状態になりたがるので
次の2パターンの方法で不対電子を電子対にして
安定化しようとします。
原子が安定化する方法
・パターン1
[原子からイオンになることで安定化]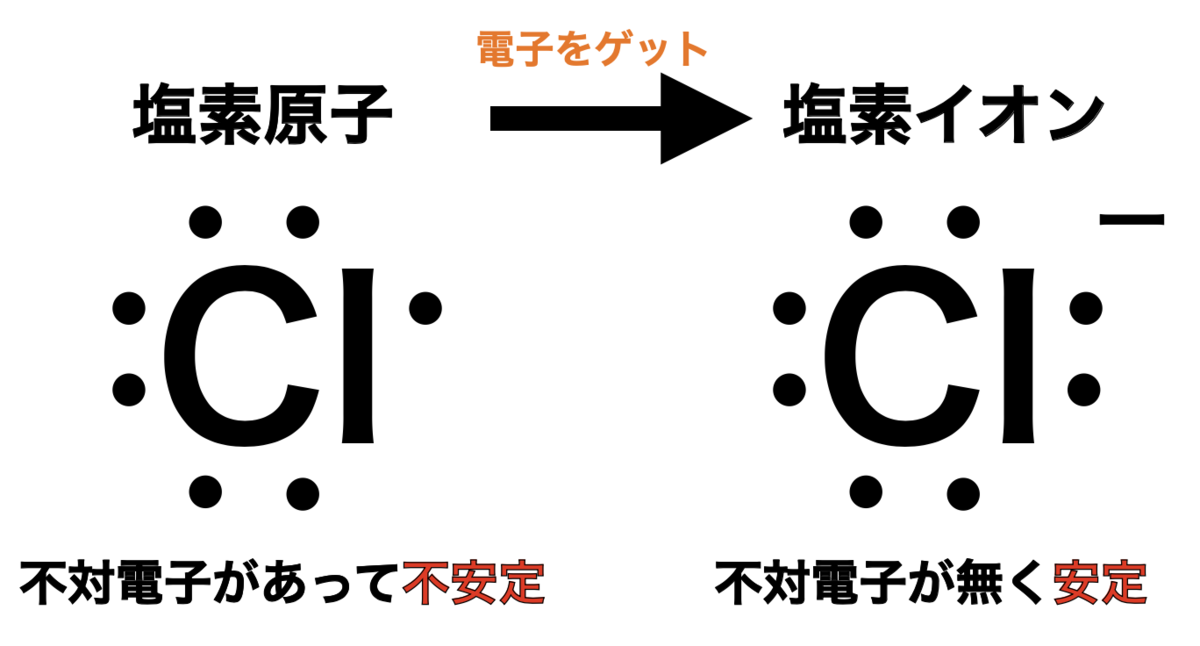
塩素原子は1つ電子をゲットすると陰イオンに
なって電子対が4つになるので安定化する。www.kemisupea.com
・パターン2
[共有結合することで安定化]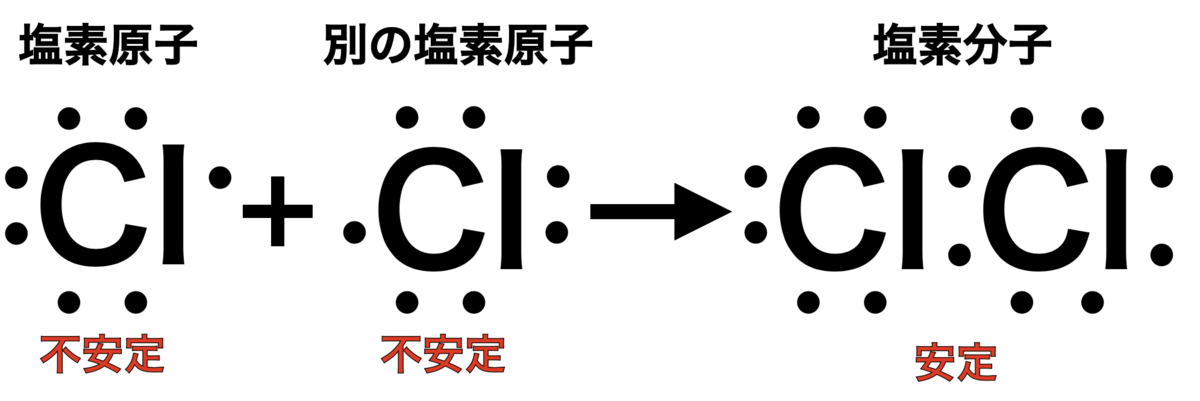 塩素原子は不対電子を
塩素原子は不対電子を
別の塩素原子の不対電子と共有します。
これをお互いに1つの電子対として扱うことで
塩素分子(Cl2)になり安定化することができます。
このパターン2のように結合することを
共有結合と言います。
そして電子を
共有してない電子対を非共有電子対,
共有している電子対を共有電子対と言います。
続いて共有結合の特徴を紹介します。
共有結合の特徴と見分け方
共有結合の特徴は主に次の2つです。
①原子が価電子を共有することでできる。
②非金属同士の結合でできてる。
①はこの記事の前半で説明したので
ここでは②について説明していきます。
共有結合は非金属同士でできたものですが
元素が非金属なのかは下のような
周期表を見ることで分かります。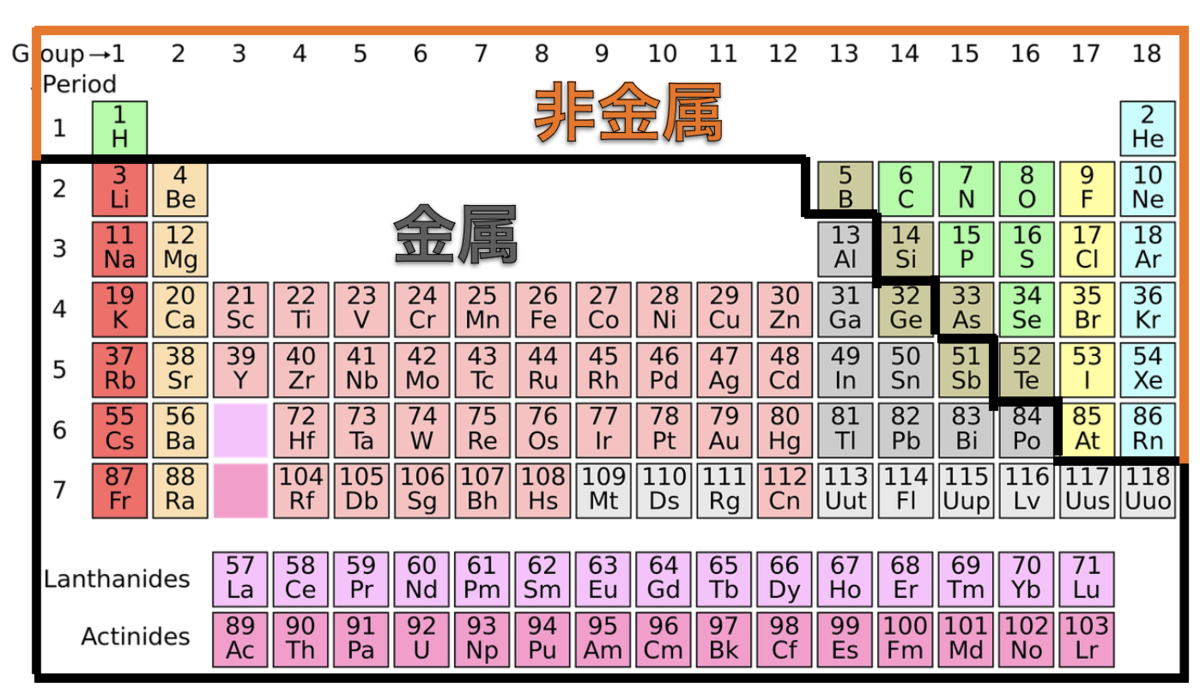
例えば先ほど出てきた塩素分子の
Cl2はClとClの結合です。
つまり非金属同士の結合なので
塩素分子は共有結合だと見分けられます。
ちなみに金属と非金属ならイオン結合
なので金属なのか非金属かは
共有結合とイオン結合を見分ける重要なポイントです。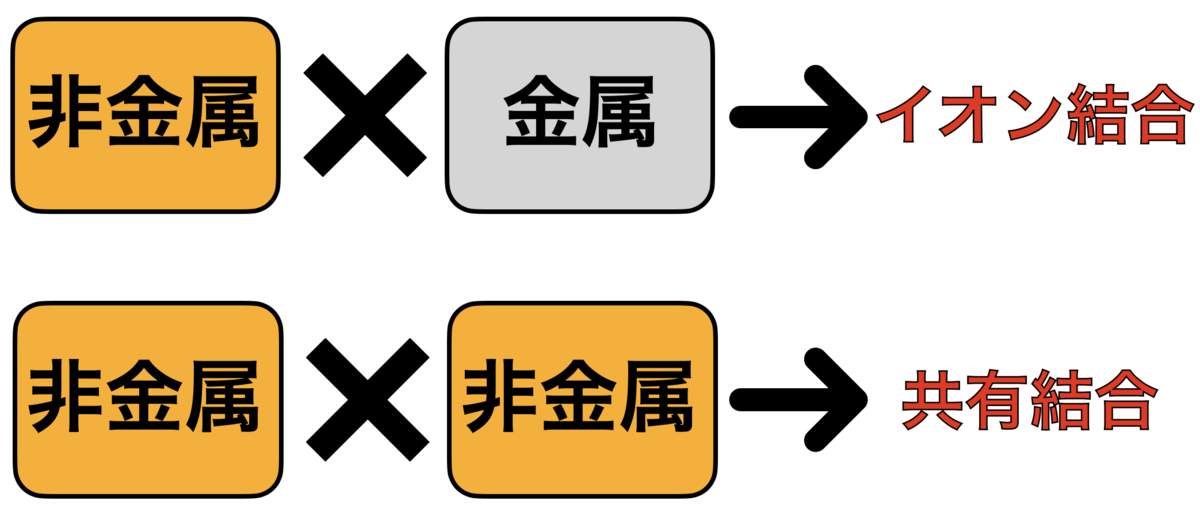
では見分け方もわかったところで
他の共有結合の例も見ていきましょう。
共有結合の例
共有結合している代表的な物質の例は
①水素(H2)
②酸素(O2)
③窒素(N2)
④メタン(CH4)
⑤アンモニア(NH3)
⑥二酸化炭素(CO2)
などがあります。
これらの電子式を書くと次のようになります。
①水素(H2)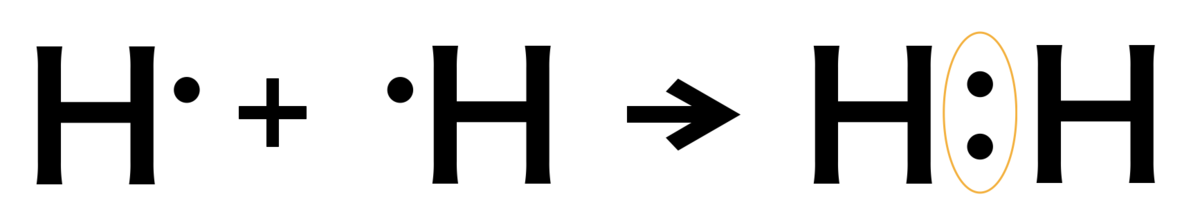
水素原子は価電子が1つなので黒丸が1つ
これを別の水素原子と電子を共有する事で
共有電子対(黄色で囲ったやつ)が完成して
安定化する。
②酸素(O2)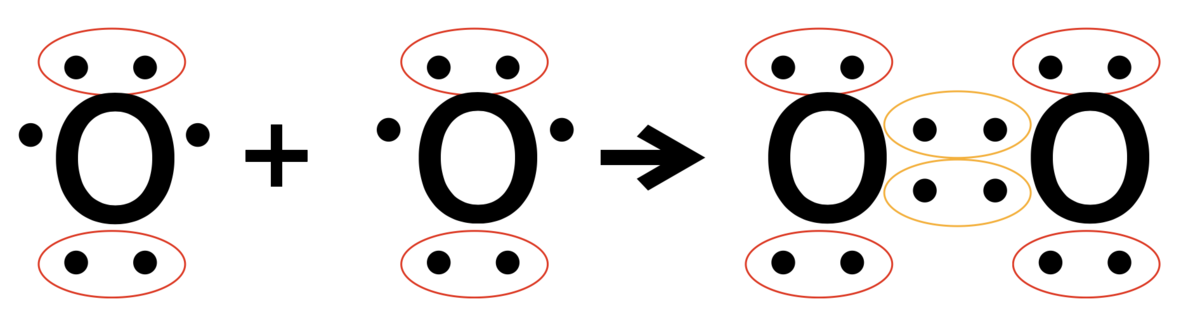
酸素原子は価電子が6個でそのうち2つが不対電子です。
なので安定化するためにお互いに2つずつ電子を出し合って共有電子対を2つ作ります。
⚠️このように電子を8個ずつにする為には
共有電子対は必ずしも1つとは限らないので
注意しましょう。
③窒素(N2)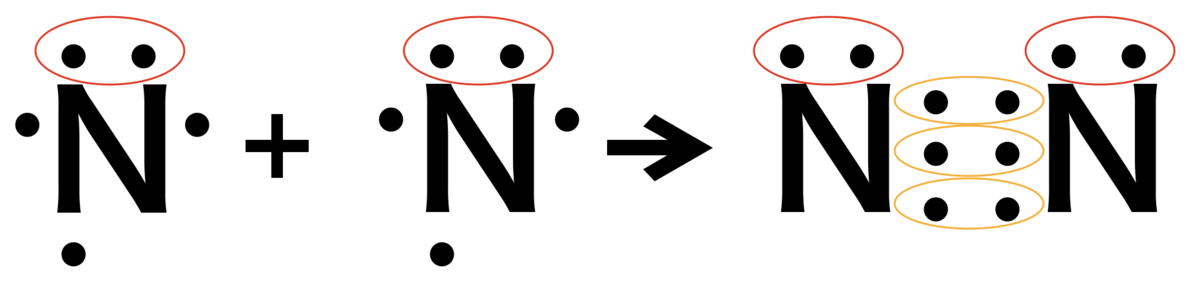
窒素原子は価電子が5個で
そのうち3つが不対電子なので
お互いに3つずつ電子を出し合って
共有電子対を3つ作ります。
④メタン(CH4)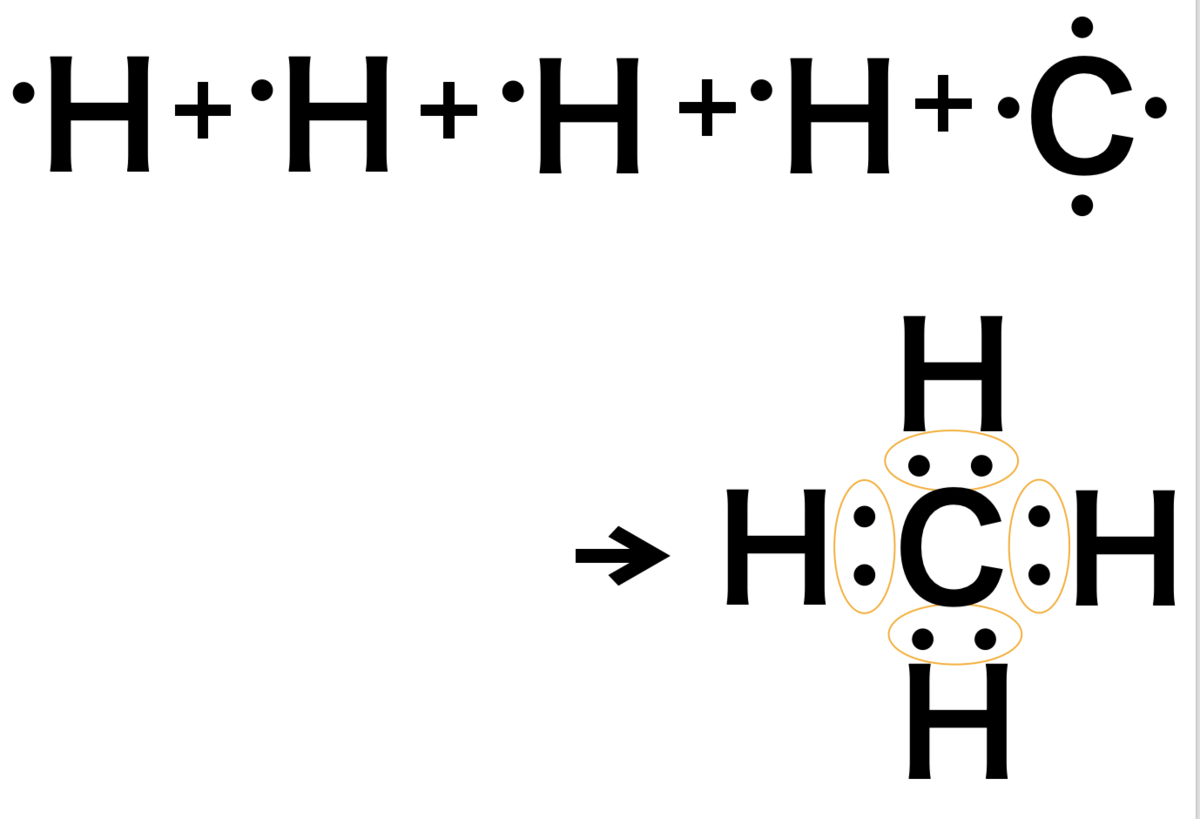 メタンは
メタンは
炭素原子は価電子と不対電子ともに4個
水素原子は価電子と不対電子ともに1個
なので炭素原子の周りに4つの水素が
共有電子対を計4つ作ります。
⑤アンモニア(NH3)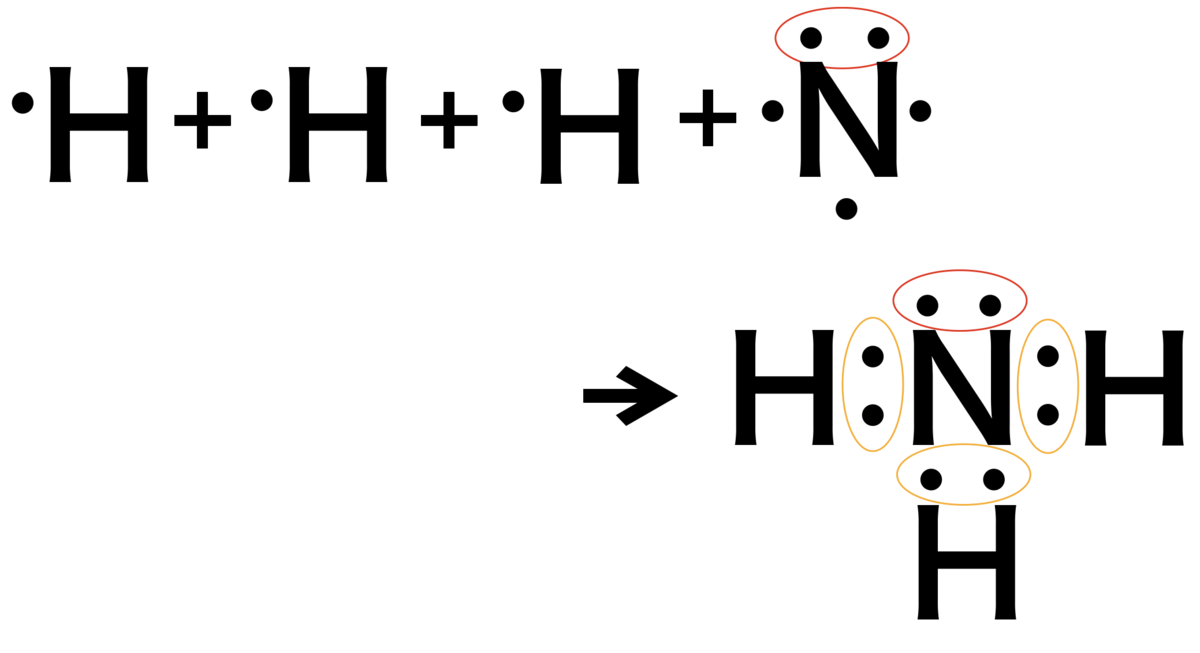 アンモニアも先ほどのメタンと似たように
アンモニアも先ほどのメタンと似たように
不対電子3個を持つ窒素原子が
3つの水素と共有電子対を3つ作ります。
そして窒素原子は元々
非共有電子対を1つ持っているので
アンモニアは
非共有電子対を1つ,共有電子対を3つ
持っていることになります。
⑥二酸化炭素(CO2)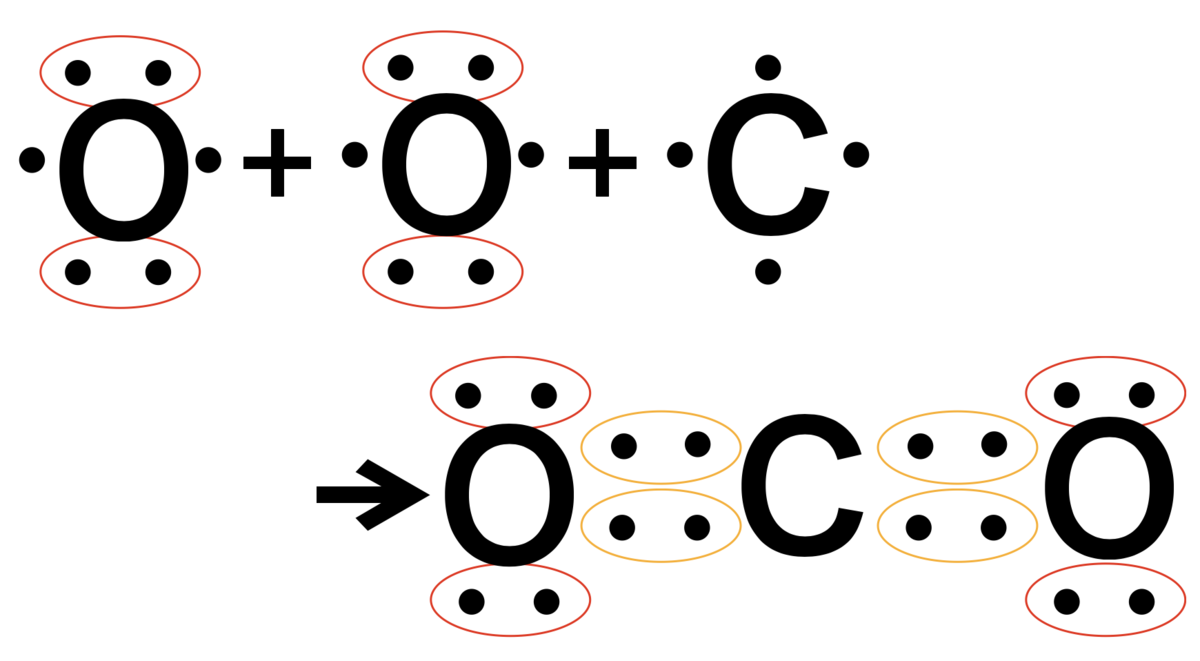 4個の不対電子を持つ炭素に
4個の不対電子を持つ炭素に
酸素が電子を2個ずつ共有することで
二酸化炭素ができます。
これらのように共有結合は
電子を8個(電子対4個)にするのが
基本パターンです。(水素は例外)
続いて電子式の別の表記(構造式)
について解説したいのですが長くなるので
次回解説します。
まとめ
・共有結合は価電子を共有することでできる結合
・下図のように最外殻電子を表したものを
電子式という
・ペアの事を電子対,
ペアになってない電子を不対電子という
・共有してない電子対を非共有電子対,
電子を共有している電子対を共有電子対という
・電子は8個ずつ(電子対4つ)だと安定
ただし水素は例外で電子2個(電子対1つ)で安定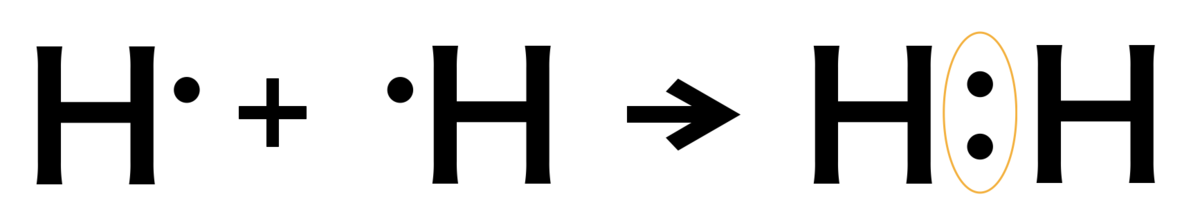
・共有結合は電子8個ずつ(電子対4つ)を
目指すので共有電子対は1つとは限らない
・共有結合の特徴と見分け方
①原子が価電子を共有することでできる
②非金属同士の結合でできてる
今回は以上です。
ご覧いただきありがとうございました。
もし「良いね」って思っていただけたら
下から読者登録していただけると嬉しいです。